HISTORIA BNCT
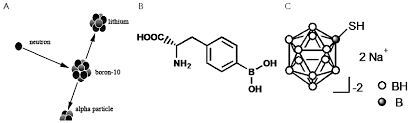
Historia BNCT rozpoczyna się krótko po odkryciu neutronów przez Chadwick’a 1932 r.[1] w 1932 r. Trzy lata później Taylor i Goldhaber[2] opisali reakcję wychwytu neutronów na jądrze boru, której efektem było rozszczepienie jądra 11B na atom helu 4He (cząsteczka α) oraz jony litu 7Li:
10B + nth →[11B] → α + 7Li + 2.31 MeV (1)
W 1936 r. Locher[3] opublikował propozycję wykorzystania wychwytu neutronów dla terapii nowotworów.
W 1951 r. Sweet[4] zasugerował stosowanie BNCT dla najbardziej złośliwych guzach mózgu. Pierwsze próby kliniczne wykonano w Brookhaven National Laboratory (BNL) przy terapii glejaków wielopostaciowych, później również w Massachusetts Institute of Technology (MIT). Do generacji neutronów wykorzystano tamtejsze reaktory badawcze, generujące neutrony o energiach termicznych (< 0.4 eV). Jako nośnik boru zastosowano Borax, nie mający właściwości selektywnych. Efekty nie były zadowalające, próby kliniczne na BNL i MIT zakończono w 1961 r. przede wszystkim ze względu na:
– słabą penetrację neutronów termicznych w tkankach
– wysokie stężenie boru we krwi, wyższe niż w komórkach nowotworowych
– przy leczeniu głęboko położonych nowotworów znajdowano żywe komórki guza, mimo stosowania wysokich dawek, przekraczających poziom tolerancji tkanek zdrowych i powodujących uszkodzenia tkanek powierzchniowych
– uszkodzenia skalpu i naczyń krwionośnych mózgu
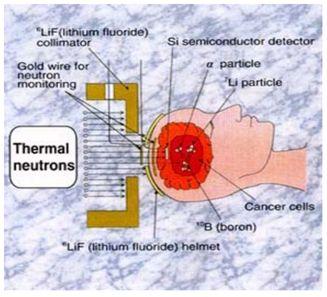
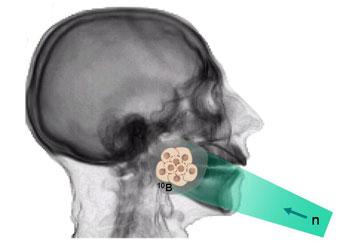
Nie były to jednak przesłanki do zaniechania badań nad wykorzystaniem BNCT. Skupiono uwagę na ulepszeniu nośników boru. W 1968 r. uruchomiono kolejne kliniczne badania, tym razem w Japonii, gdzie Hatanaka wprowadził nowe związki boru (BSH), o wyższej selektywności i lepszej koncentracji w komórkach nowotworowych [5]. Hatanaka zapewnił również wyższą skuteczność penetracji promieniowania neutronowego przeprowadzając BNCT śródoperacyjnie, na otwartym skalpie (Rys. 1).
Efekty terapii były dużo lepsze niż przy poprzednio, chociaż średnia przeżycia nie różniła się tej osiąganej w radioterapii konwencjonalnej. Ponieważ naświetlano nadal neutronami termicznymi, leczono jedynie nowotwory położone płytko. Terapii BNCT poddanych zostało wówczas 120 pacjentów.
Następnym etapem było poniesienie energii neutronów do epitermalnej (0.4 eV – 10 keV), uzyskując głębszą penetrację, oszczędzenie tkanek powierzchniowych oraz wyższą dawkę deponowaną w obszarze guza, dzięki termalizacji neutronów w tkankach pośrednich. Dalszy rozwój nośników boru doprowadził do wytworzenia BPA-f (Borophenylalanine-fructose complex), cząsteczki, która potrafiła wprowadzić atomy boru do środka komórki, przenikając przez membranę błony komórkowej. Nowa faza badań klinicznych rozpoczęła się w 1994 r. na BNL, gdzie po raz pierwszy wykorzystano wiązkę neutronów epitermalnych, w tym samym roku terapię rozpoczęto także na MIT. Zainteresowanie BNCT wzrosło również w Europie. W 1996 r. BNCT zaczęto prowadzić w Petten (Holandia), podobne ośrodki powstały również w Finlandii.
Podobnie jak w przypadku innych metod radioterapii, szybsze komputery oraz rozwój technik obrazowania takich jak MRI i PET znacznie poprawiły planowanie leczenia dla BNCT i pozwoliły na dalszy jego rozwój. Aktualne badania dotyczą: poprawy jakości wiązki neutronów, opracowania metod dokładnej kalkulacji dawki, znalezienia nowych nośników boru, znalezienia alternatywnych źródeł neutronów, generujących wiązki o energiach epitermalnych (1 eV – 10 keV) o głębokim zasięgu.
[1] Chadwick, J., (1932), Proc. Roy. Soc. Lond. A, 136, 692-708.
[2] Taylor, H. J., Goldhaber M (1935), Nature (Lond.), 135, 341–348.
[3] Locher, G. L., (1936), Amer. J. Roentgenol. Radium Ther., 36, 1–13.
[4] Sweet, W. H. (1951), The uses of nuclear disintegration in the diagnosis and treatment of brain tumor, New England Journal of Medicine, 245 (23): 875–8, doi: 10.1056/NEJM19511206245230
[5] H. Hatanaka, (1986), Clinical experience of boron-neutron capture therapy for gliomas – a comparison with conventional chemo-immuno-radiotherapy, In: H. Hatanaka ed Boron Neutron Capture Therapy for Tumours. Nishimura Co., Niigata 349-379
http: //www. osaka-u. ac. jp/en/news/ResearchRelease/2013/09/20130906_1
[6] Coderre JA, Morris GM. The radiation biology of boron neutron capture therapy. Radiat Res 1999;151:1–18.
[7] Morris GM, Coderre JA, Hopewell JW., et al. Response of the central nervous system to boron neutron capture irradiation: evaluation using rat spinal cord model. Radiother Oncol 1994;32:249–55.
[8] Morris GM, Coderre JA, Hopewell JW., Micca PL, Rezvani M. Response of rat skin to boron neutron capture therapy with p-boronophenylalanine or borocaptate sodium. Radiother Oncol 1994;32:144–53.
FIZYKA BNCT
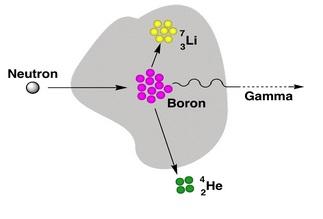
Boron Neutron Capture Therapy (Terapia borowo-neutronowa) jest rodzajem dwumodalnej radioterapii opartej na selektywnym dostarczeniu stabilnego nuklidu boru (10B) do komórek nowotworu, który następnie zostają poddane naświetlaniu niskoenergetycznym promieniowaniem neutronowym. Neutrony o energiach termalnych zderzają się z borem powodując reakcję jądrową (reakcję rozpadu), której następstwem jest silnie skoncentrowana generacja promieniowania o wysokim LET.
W wyniku reakcji powstają cząsteczki α o wysokim LET oraz jądra odrzutu 7Li:
10B + nth → 4 He2+ + 7Li 3+ + 2,79 MeV (6%) (1)
10B + nth → 4 He2+ 7Li 3+ + 2,31 MeV + γ (0,48 MeV) (94%) (2)
W czasie reakcji neutron ulega wychwytowi na jądrze atomu boru tworząc metastabilne jądro 11B, które spontanicznie i niemalże natychmiastowo rozpada się na cząsteczki 4He i 7Li. Obie cząsteczki przemieszczają się odpowiednio o ok. 9µm i 5µm w przeciwnych kierunkach. Są to odległości porównywalne ze średnicą wielu komórek nowotworowych.
Przy założeniu selektywności dostarczenia boru opisana reakcja oznacza silnie zlokalizowaną dawkę promieniowania o wysokim LET, oszczędzającą zdrowe komórki.
Energia stosowanego promieniowania neutronowego zależy od głębokości położenia guza. Neutrony termiczne (<0.05 eV) mogą być zastosowane przy naświetlaniu nowotworów powierzchniowych, neutrony epitermalne (1 eV- 10,000 eV) - przy głębiej położonych guzach, ponieważ mają większy zasięg penetracji. Neutrony podróżując przez tkanki zostają stopniowo spowalniane. Kiedy osiągną energie termalne mogą ulec wychwytowi na jądrze 10B, skoncentrowanym w komórkach nowotworowych.
BNCT jest dobrze rokującym rodzajem terapii w przypadku nowotworów odpornych na tradycyjne techniki terapii, głównie glioblastoma i melanoma. Glioblastoma to złośliwy nowotwór mózgu, o słabych prognozach przeżycia pacjenta (czas przeżycia liczony w miesiącach). Melanoma jest typem nowotworu skóry, który może przerzutować na ważne dla życia organy, w tym mózg. Wymienione nowotwory zwykle są rozległe (rozprzestrzenione) i słabo utlenowane, co utrudnia zarówno ich chirurgiczne wycięcie jak i zastosowanie radioterapii. W przypadku glioblastomy, ze względu na barierę krew-mózg nieefektywna jest również chemioterapia. BNCT może dawać pozytywne rezultaty w przypadku leczenia tych nowotworów, ponieważ wykorzystuje metody selektywnego dostarczenia wysokich dawek promieniowania do komórek nowotworowych.
Do niedoskonałości techniki BNCT należy zaliczyć trudności z generacją i kontrolą wiązki neutronów właściwą dla terapii oraz problematykę selektywnego dostarczenia i właściwej koncentracji boru w komórkach nowotworowych.
Źródło rys. http://nanomed.missouri.edu/institute/research/BNCT.html
CHEMIA BNCT CZYLI O ZWIĄZKACH BORU
Nośniki dostarczające bor do organizmu muszą charakteryzować się niską toksycznością i selektywnością gromadzenia w tkankach nowotworowych.
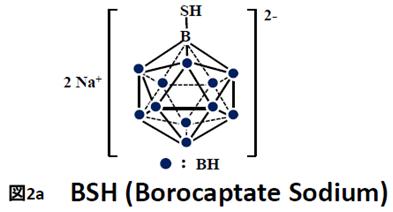
Pierwszymi związkami boru wykorzystywanymi w BNCT były BSH (di-sodium undecahydro-mercapto-closo-dodecacarborate Na2B12H11SH), i BPA (p-boronphenylalanine C9H12BNO4) schematycznie przedstawione na rys. 2. Oba związki wykorzystują różne mechanizmy dostarczania boru do komórek nowotworowych.
BSH działa na zasadzie pasywnej dyfuzji z krwi do komórek nowotworowych w mózgu. Bariera krew-mózg (ang. blood brain barier – BBB) jest zakłócana przez komórki nowotworowe, dzięki czemu dyfuzja z krwi do komórek patologicznych jest możliwa. Jednocześnie BSH nie może wniknąć do komórek zdrowych, gdzie bariera jest nienaruszona. Badania wykazały, że BSH może wniknąć selektywnie do komórek mózgu jeśli stosunek nowotwór/krew wynosi od 1:1 do 2:1,6 [2].
BPA jest aminokwasem z dołączonym atomem boru, stanowiącym biomolekułę i podlegającym aktywnemu wychwytowi przez komórki nowotworowe. Komórki patologiczne wykazują zwiększony transport membranowy aminokwasów, ze względu na swój gwałtowny wzrost i podziały. Większy niż komórki zdrowe. Badania wykazały, że koncentracja BPA w komórkach zdrowych, w porównaniu do komórek krwi i innych zdrowych tkanek jest 2–4 razy wyższa.
Niestety, ani BPA, ani BSH, nie wnikało do komórek nowotworowych w sposób jednorodny, dlatego rozkład koncentracji boru nie był jednolity, a zatem dostarczana dawka również. Oznacza to, że istnieje część komórek nowotworowych, które po przeprowadzeniu terapii pozostaną nieuszkodzone i zdolne do dalszych podziałów. Nie należy również lekceważyć pewnej koncentracji związków, pozostającej w zdrowych tkankach i komórkach krwi. Maksymalna ilość BPA czy BSH musi podlegać limitowi dawki dopuszczalnej dla zdrowych tkanek. Aby poprawić powyższe niedoskonałości próbowano m.in. równoczesnego dostarczania BSH i BPA, opierając się na ich odmiennych mechanizmy przenikania. Liczono, że w miejscu gdzie transport pasywny będzie nieefektywny nastąpi wychwyt aktywny, dzięki czemu koncentracja boru ustali się na jednakowym poziomie. Niestety, nie osiągnięto zadowalających rezultatów.
Lepsze efekty uzyskano stosując liposomy ładowane borem (liposome-loaded bor) i borowane porfiryny. Liposomy są stosowane jako nośniki nie tylko w terapii nowotworowe. Wykorzystuje się ich biokompatybilność (zbudowane z takich samych składników jak błony komórek organizmu), a więc także niską toksyczność. Dobierając odpowiednio rozmiar liposomu, można zapewnić przechodzenie przez ściany naczyń krwionośnych w szczególnych miejscach. W przypadku występowania stanu zapalnego, ściany naczyń mają spore przestrzenie między komórkami i liposomy mogą opuścić naczynie krwionośne i skoncentrować się tam, gdzie taki stan występuje. Ponieważ normalne ściany naczyń są słabo przepuszczalne, liposomy nie wychodzą z krwiobiegu tak długo, aż nie trafią tam, gdzie są potrzebne: w okolicy stanu zapalnego, spowodowanego przez infekcję bakteryjną, wirusową lub proces nowotworowy. Dzięki temu liposomy przenoszące bor kumulują się w obrębie guza nowotworowego. Jest to tzw. bierna akumulacja liposomów.
Porfiryny należą do grupy aromatycznych związków tetrapirolowych, z których niektóre występują naturalnie w roślinach i zwierzętach (np. chlorofil i hem). Porfiryny wykazują
wykazują duże powinowactwo do tkanek nowotworowych, niską cytotoksycznością i łatwość syntezy dużej ilości boru. Jako nośniki są wykorzystywane również przy terapii fotodynamicznej (PDT).
[1] Floberg J., The physics of boron neutron capture therapy: an emerging and innovative treatment for glioblastoma and melanoma, http://digitalcommons.carleton.edu/pacp/8
[2] J. A. Coderre, J. C. Turcotte, K. J. Riley et al., Technology in Cancer Research & Treatment 2 (5), 355 (2003).
RADIOBIOLOGIA
Pewne komplikacje związane są ze złożonością określenia dostarczonej dawki. Podczas reakcji 10 B (n, α) 7Li (1) powstaje kilka rodzajów cząsteczek jonizujących: fotony, cząstka alfa i jądro odrzutu, a podczas reakcji neutronów ze zdrowymi tkankami zachodzą reakcje 14 N (n, p) 14 C oraz 1 H (n, γ) 2D: 14 N + nth → 14 C + 1H+ + 0,626 MeV (3) 1 H + nth → 2D + γ γ(γ2,2 MeV) (4)
Wszystkie te cząsteczki mogą oddziaływać zarówno z komórkami nowotworowymi jak i zdrowymi. Powszechnie przyjmuje się, że istnieją cztery osobne składniki dawki w BNCT: – promieniowanie protonowe o wysokim LET powstające w reakcji 14 N (n, p) 14C- promieniowanie protonowe o wysokim LET powstające w wyniku rozpraszania szybkich neutronów- promieniowanie α o wysokim LET powstające w reakcji 10 B (n, α) 7Li oraz w wyniku rozpadu jądra4He- promieniowanie γ o niskim LET, powstające głównie w wyniku reakcji wychwytu 1 H (n, γ) 2D oraz wtórnie jako ’zanieczyszczenia’ pierwotnej wiązki neutronów
Im większa gęstość jonizacji wzdłuż toru cząstki (czyli im większe LET), tym większy efekt biologiczny w porównaniu z cząstką, która tę samą energię przekazuje na dłuższej drodze. Parametrem charakteryzującym tą zależność jest RBE (Relative Biological Effectiveness) definiowany jako stosunek dawki pochłoniętej od promieniowania referencyjnego do wartości dawki promieniowania badanego, wywołującej ten sam efekt biologiczny. Ponieważ zarówno komórki nowotworowe jak i zdrowe znajdują się w polu napromienienia, są narażone pewne promieniowanie dodatkowe o nieokreślonym składzie, zawierające komponenty zarówno o niskim i wysokim LET, nawet przy zapewnieniu idealnej wiązki neutronów epitermalnych. Zapewnienie wyższej koncentracji 10 B w komórkach nowotworowych zapewni wyższą dawkę deponowaną w ich obrębie, niż w sąsiadujących komórkach zdrowych. Jest to podstawowa zaleta terapii BNCT.
SKUTECZNOŚĆ BIOLOGICZNA
Zależność efektu biologicznego od mikrorozkładów 10B wymaga zdefiniowania wskaźnika nieco bardziej adekwatnego niż RBE. Wyznaczone wartości współczynników skuteczności biologicznej dla każdego ze składników dawki, zależne od stosowanych nośników 10B, zostały nazwane CBE (Compound biological effectiveness factors). Sposób i droga dostarczania leku, rozkład boru w tkankach oraz komórkach zdrowych i nowotworowych, a nawet rozmiary jąder kolonii komórek nowotworowych mają wpływ na wartość CBE.
![Struktura chemiczna BPA oraz BSH i CuTCPH oraz liposom z borem [Rolf F. Barth et al., Neurosurgery 44 (3), 433 (1999)]. Struktura chemiczna BPA oraz BSH i CuTCPH oraz liposom z borem [Rolf F. Barth et al., Neurosurgery 44 (3), 433 (1999)].](/sites/default/files/styles/large/public/projekt/chemia-bnct3.jpg?itok=T15-5S-I)